Brachyterapia raka prącia
Dr n. med. Sylwia Kellas-Ślęczka
Zakład Brachyterapii, Narodowy Instytut Onkologii im. Marii Skłodowskiej-Curie – Państwowy Instytut Badawczy w Gliwicach
Rak prącia występuje stosunkowo rzadko i stanowi 0,3% wszystkich nowotworów u mężczyzn. W 2019 roku rozpoznano w Polsce 252 nowe przypadki. Choroba pojawia się najczęściej po 60 roku życia. Czynnikami predysponującymi do jego wystąpienia mogą być stulejka, przewlekłe stany zapalne oraz palenie tytoniu. W większości przypadków jest to rak płaskonabłonkowy, który najczęściej jest zlokalizowany w okolicy żołędzi lub napletka.
W początkowym okresie rak prącia może mieć postać małego guzka, stwardnienia, owrzodzenia lub zaczerwienienia, którym mogą towarzyszyć dolegliwości bólowe, krwawienie lub nieprawidłowa wydzielina z cewki moczowej. Nieleczona choroba rozwija się zajmując coraz większy obszar tkanek, często dając przerzuty do węzłów chłonnych i innych narządów. Potwierdzenie rozpoznania jest możliwe po pobraniu wycinka ze zmiany.
W zależności od stopnia zaawansowania choroby w momencie rozpoznania, na podstawie badania histopatologicznego oraz po przeprowadzeniu odpowiedniej diagnostyki obrazowej ustala się schemat postępowania i kwalifikację do leczenia: chirurgicznego, radioterapii, chemioterapii lub leczenia skojarzonego. Choroba wcześnie rozpoznana, o niskim zaawansowaniu, pozwala u części chorych na zastosowanie leczenia oszczędzającego, będącego szansą na uniknięcie amputacji prącia. Podstawą leczenia jest postępowanie chirurgiczne, które polega na usunięciu guza prącia z marginesem zdrowych tkanek oraz w przypadku wskazań, na usunięciu regionalnych węzłów chłonnych.
Do zabiegów oszczędzających oprócz metod chirurgicznych należy także brachyterapia. Jest to najstarsza metoda radioterapii wykorzystywana w leczeniu nowotworów od ponad 100 lat. W brachyterapii podstawą leczenia jest umieszczenie źródła promieniowania w guzie bądź jego bliskim sąsiedztwie. W leczeniu raka prącia dysponujemy techniką śródtkankową oraz kontaktową. Brachyterapia śródtkankowa jest metodą zabiegową polegającą na wprowadzeniu cienkich, plastikowych drenów bezpośrednio w zmianę nowotworową oraz jej najbliższe sąsiedztwo (Ryc. 1). Mimo, iż jest to technika inwazyjna, wyniki wielu badań wskazują na jej dużą skuteczność w zachowaniu narządu oraz jego funkcji. Metoda kontaktowa brachyterapii w leczeniu raka prącia jest rzadziej wykorzystywana, tylko u chorych spełniających ścisłe, restrykcyjne warunki kwalifikacji. Polega ona na wykonaniu indywidualnego aplikatora z masy plastycznej, który w trakcie terapii jest przykładany na zmienioną okolicę (Ryc. 1).
Do brachyterapii kwalifikowani są chorzy po nieradykalnym usunięciu guza prącia z dodatnimi marginesami pooperacyjnymi bądź pacjenci, u których pobrano tylko wycinki ze zmiany, ponieważ ze względu na jej rozległość i lokalizację, usunięcie w całości byłoby niemożliwe bez konieczności znacznego okaleczenia.
Pacjenci, u których planowana jest brachyterapia, muszą wcześniej przejść zabieg obrzezania w oddziale urologicznym. Pozwala on zmniejszyć dolegliwości i ryzyko ewentualnych powikłań w czasie leczenia promieniami.
U niektórych chorych z wcześnie rozpoznaną chorobą możliwe jest przeprowadzenie samodzielnej brachyterapii prącia. W przypadkach bardziej zaawansowanych lub w obecności niekorzystnych czynników ryzyka konieczne jest połączenie kilku metod leczenia np. radioterapii z chirurgicznym usunięciem węzłów chłonnych pachwinowych.
Pacjenci zakwalifikowani do zabiegu brachyterapii przyjmowani są do szpitala na okres ok. 2 tygodni. Sam zabieg trwa ok. 20–30 minut i jest wykonywany w znieczuleniu ogólnym lub przewodowym. Na czas całego procesu leczenia do pęcherza moczowego wprowadzany jest cewnik Foley’a. Następnie bezpośrednio w zmianę i jej najbliższe otoczenie wkłuwane są specjalne igły, przez które wprowadza się plastikowe dreny. Ich liczba oraz rozmieszczenie zależy od wielkości zmiany nowotworowej i najczęściej waha się od 3 do 8. Podczas zabiegu może wystąpić krwawienie, które najczęściej samoistnie ustępuje w ciągu kilku minut.
Bezpośrednio po wykonaniu implantu (wprowadzeniu drenów) wykonywana jest tomografia komputerowa bez kontrastu. Na jej podstawie, w ciągu ok. dwóch godzin fizyk medyczny wspólnie z lekarzem przygotowuje dla każdego chorego indywidualny plan leczenia. Napromienianie rozpoczyna się tego samego lub kolejnego dnia.
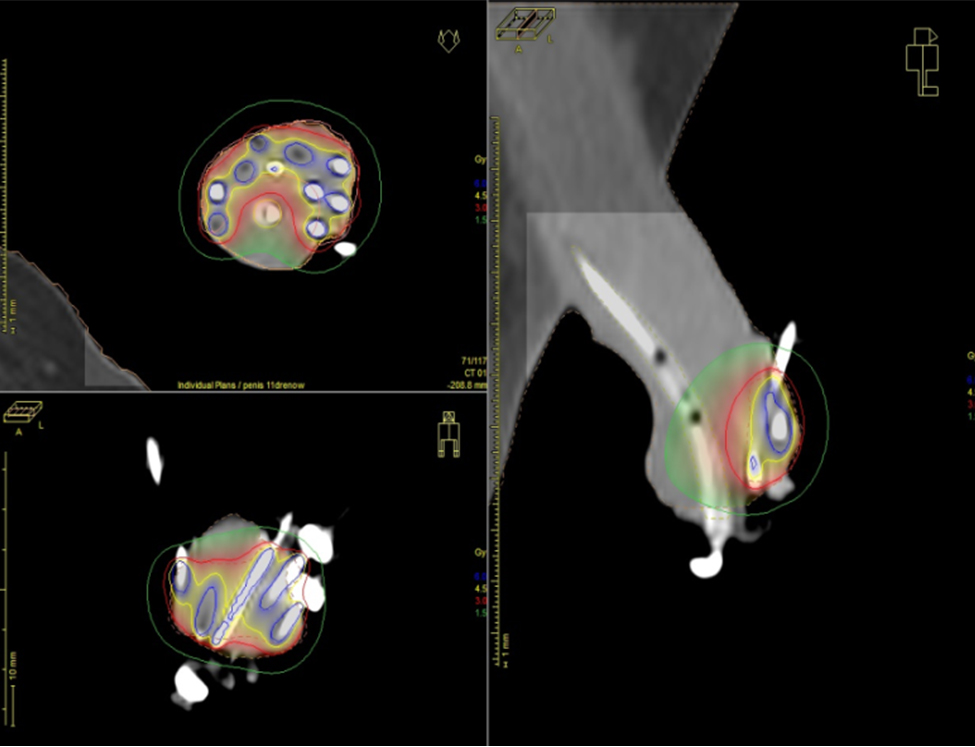
Ryc. 1 Przykładowy rozkład dawki zaplanowany na obrazach tomografii komputerowej.
Dreny są tak skonstruowane, aby można było do nich podpiąć specjalne przewody, którymi maleńkie źródło promieniowania (najczęściej Iryd-192) dostaje się w okolicę guza. W czasie napromieniania, które trwa najczęściej kilka minut, pacjent pozostaje sam w specjalnym pomieszczeniu z kamerami (bunkier), w stałej łączności z personelem. Po zakończonym napromienianiu źródło jest automatycznie chowane w specjalnym urządzeniu (afterloader), a personel medyczny wchodzi ponownie do pomieszczenia terapeutycznego. Przewody są odpinane od drenów, a pacjent wraca na oddział. Ten proces jest powtarzany podczas każdej frakcji napromieniania. Jest on bezbolesny i nie wymaga od pacjenta specjalnego przygotowania. Promieniowanie występuje tylko przez kilka minut leczenia, a po jego zakończeniu pacjent może bezpiecznie przebywać w bliskości z innymi osobami.
Schematy leczenia mogą nieznacznie różnić się między ośrodkami. W NIO-PIB w Gliwicach stosuje się pojedynczą dawkę 3 Gy. Pacjent zgłasza się do Zakładu Brachyterapii dwa razy dziennie z przerwą co najmniej 6-godzinnną pomiędzy dawkami. Leczenie prowadzone jest przez 5 dni w tygodniu od poniedziałku do piątku, z przerwą w czasie weekendu oraz dni świątecznych wolnych od pracy.
Leczenie promieniowaniem jonizującym może wywołać skutki uboczne, których wystąpienie nie jest regułą, ale jest obarczone ryzykiem. Szczególnie narażone na wystąpienie objawów ubocznych jest prącie, skóra i tkanka podskórna w okolicy napromienianej, cewka moczowa oraz moszna. Większość objawów niepożądanych występujących w trakcie leczenia jest odwracalna, jednak niektóre mogą wymagać dodatkowego postępowania medycznego. W czasie leczenia w okolicy napromienianej pojawiają się objawy miejscowego stanu zapalnego. Najczęściej występuje zaczerwienienie, obrzęk i tkliwość podczas dotyku. Obserwuje się łuszczenie naskórka. W wyjątkowych sytuacjach może wystąpić zapalenie pęcherza moczowego. W przypadkach bardziej nasilonych dolegliwości u części chorych konieczne jest włączenie leków przeciwbólowych lub antybiotykoterapii.
W ostatnim dniu leczenia, bezpośrednio po zakończonym napromienianiu dreny są usuwane. Jeżeli jest to koniecznie, usunięcie implantu może być wykonane w znieczuleniu. W tym samym dniu lub na kolejny dzień usuwany jest także cewnik z pęcherza moczowego, a pacjent może zostać wypisany do domu.
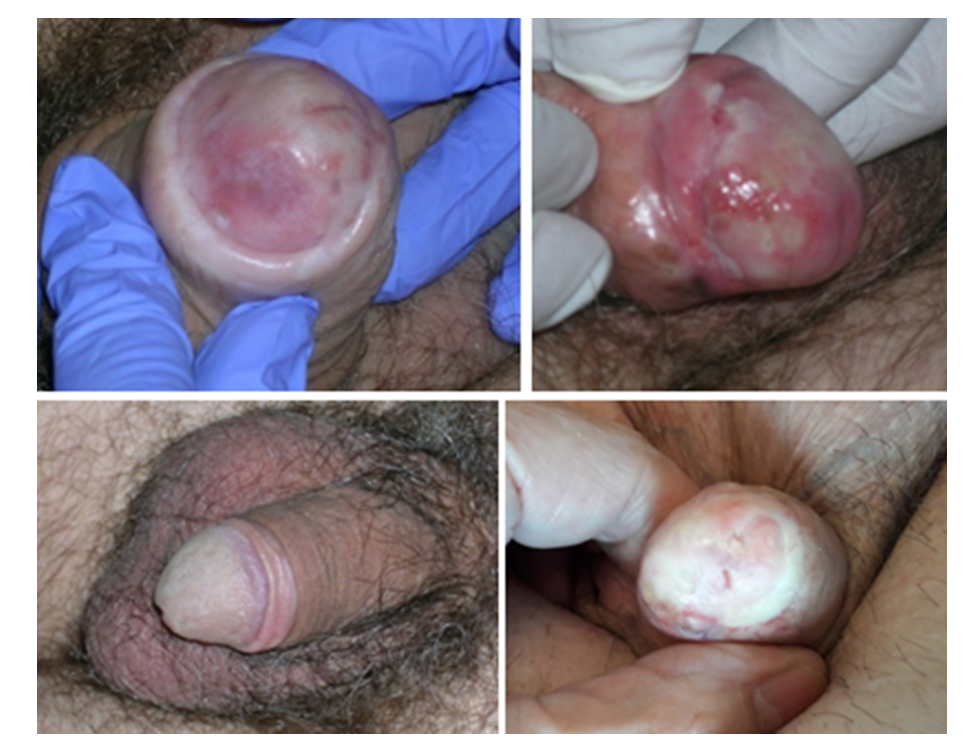
Ryc. 2 Przykładowe zmiany w obszarze napromienianym po brachyterapii.
Po zakończonym leczeniu, w ciągu kliku tygodni lub miesięcy, w okolicy napromieniaj u niektórych chorych pojawiają się przebarwienia lub odbarwienia tkanek (Ryc. 2). Czasem obserwuje się stwardnienie lub zwłóknienie prącia w miejscu uprzednio leczonym. Bardzo rzadko może wystąpić zwężenie cewki moczowej i utrudnione oddawanie moczu wymagające w pewnych sytuacjach interwencji urologicznej i zabiegowego poszerzania cewki. U nielicznych chorych w okolicy napromienianej może pojawić się nienowotworowe owrzodzenie z martwicą tkanek wymagające postępowania chirurgicznego.
Wszyscy pacjenci po leczeniu brachyterapią pozostają w stałych i regularnych kontrolach w ośrodku leczącym.





